PER 1 - GASES Y SOLUCIONES
GASES
El estado gaseoso es uno de los estados de agregación de la materia que existen, compuesto por moléculas cargadas de energía, que no se hallan entre ellas unidas y que no ejercen entre sí fuerza de atracción, lo que genera que no tengan volumen ni forma precisa. Pero para introducirnos en este concepto, te invito a visitar la siguiente página dándole clic al link ubicado debajo de la siguiente imagen (introducción a los gases en la vida cotidiana), observa el video y responde los interrogantes que se plantean durante el video y después de él en los numerales 2 y 3.
Introducción: los gases en la vida cotidiana
A) Teoría cinética de los gases.Introducción: los gases en la vida cotidiana
Para que sigas conociendo más al respecto, leamos ahora el siguiente documento para que conozcamos un poco más sobre la teoría cinética de los gases y su comportamiento:
Teoría cinética de los gases.
A continuación podrás ver un resumen de estas en la siguiente presentación (darle clic al link) y luego observar el video para afianzar:
Los gases y sus propiedades
Ahora, para evaluar los aprendizajes adquiridos en esta etapa, desarrollaremos el siguiente taller y presentar la solución bajo las indicaciones dadas por el docente.
Taller N°1 - Teoría cinética de los gases
B) Presión y temperatura
A continuación abordaremos 2 conceptos muy importantes dentro de la comprensión de los gases, dos conceptos que nos permitirán introducirnos más delante en las leyes que explican este estado de la materia. Iniciemos observando el siguiente video:
Presión y temperatura en sólidos, líquidos y gases
La presión y la temperatura son sin duda alguna dos variables que se relacionan de manera constante y influyen una sobre la otra. Profundicemos un poco más a través de la lectura sel siguiente documento y luego mediante la solución del taller N°2.Relación entre presión y temperatura
Taller N°2 - Presión y temperatura
C) Leyes de los gases
Las primeras leyes de los gases comenzaron a desarrollarse desde finales del siglo XVII, cuando los científicos comenzaron darse cuenta de que en las relaciones entre la presión, la temperatura y el volumen de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería valida para todos los gases. Estos se comportan similar en una amplia variedad de condiciones debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y los gases se consideran como casos especiales de la ecuación del gas ideal, con una o varias de las variables constantes. Veamos en el siguiente mapa conceptual algunas de ellas y a continuación un acercamiento de manera individual:
Ley de Boyle y Mariotte
Miremos en la siguiente imagen lo que esta ley establece:
Para profundizar más en el concepto, vemos el leamos el siguiente documento y posteriormente veamos un video:
Ley de Boyle y Mariotte
Video: Ley de Boyle y Mariotte
Y ahora finalicemos con el siguiente taller:Taller N°3 - Ley de Boyle y Mariotte
Ley de Charles
En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y enunció la ley de los gases que lleva su nombre.
Su enunciado puede expresarse teórica y matemáticamente de la siguiente manera:
Video: Ley de Charles
Para profundizar más en el concepto, leeremos el siguiente documento que se presente al final de la teoría de Gay Lussac.Ley de Gay - Lussac
En 1802, este importante personaje descubrió que a volumen constante, la
presión de un gas es directamente proporcional a su temperatura.
Su enunciado puede expresarse teórica y matemáticamente de la siguiente manera:
Veamos un video al respecto:
Video: Ley de Gay - Lussac
Para profundizar más en el concepto, leamos el siguiente documento:
Ley de Charles y Gay - Lussac
Y ahora finalicemos con el siguiente taller:
Taller N°4 - Ley de Charles y Gay- Lussac
La ley de Boyle, ley de Charles y la ley de Gay Lussac se pueden combinar en una sola ley. La ecuación plantea la relación entre la presión, el volumen y la temperatura de una cantidad fija de gas. En esta, la presión es inversamente proporcional al volumen y directamente proporcional a la temperatura. el volumen es directamente proporcional a su temperatura.
Su enunciado puede expresarse teórica y matemáticamente de la siguiente manera:
Para profundizar más en el concepto, leamos el siguiente documento:
Documento: Ley combinada de los gases
Veamos un video al respecto:
Ejercicios aplicativos sobre la ley combinada de los gases
Taller N°5 - Ley Combinada de los gases
Ley general de los gases ideales
Es el comportamiento que tienen aquellos gases cuyas moléculas no interactuan entre sí y se mueven aleatoriamente. En condiciones normales y el condiciones estándar, la mayoría de los gases presentan comportamiento de gas ideal. A continuación veremos la expresión matemática que la representa:
Ahora los invito a ver un video sobre el comportamiento de los gases ideales y gases reales. Luego, vamos a leer un documento sobre este
concepto, documento que además vendrá con un algunos ejemplos matemáticos sobre
la ley:
Video comportamiento de los gases ideales y reales
Veamos un video al respecto:
Video ejercicios aplicativos sobre la ley de gases ideales
Taller N°6 - Ecuación de gases ideales
Hemos finalizado esta primera parte de nuestro
primer periodo, los gases. para darle conclusión a este concepto, a continuación,
encontrarás un link (viaje a través de las leyes) que te llevará a una plataforma digital con contenidos,
conceptos y actividades interactivas relacionadas con lo que hemos abordado y que te ayudarán a reforzar conceptos, aclarar dudas y a divertirte con la química.
Algunas de esas actividades serán tenidas en cuenta dentro del proceso. Te
invito a finalizar con todo el ánimo.
SOLUCIONES
En este sentido es importante mencionar al agua. Veamos las siguientes ideas:
El agua, presenta algunas propiedades físicas y
químicas que, como se dijo en el video anterior, permiten que sea considerada
el solvente universal. Identifiquemos estas características y miremos su estructura química.
Otras propiedades que, aunque no dependen directamente de la estructura del agua, si tienen que ver con la naturaleza del agua. Estas son la densidad y la tensión superficial. Veamos:
A) Las soluciones químicas.
El término soluciones se aplica genéricamente a toda mezcla homogénea que tenga composición variable. Las soluciones se diferencias de las mezclas heterogéneas porque sus componentes se distinguen a simple vista; de los compuestos, por su composición constante; y de las otras clases de dispersiones (suspensiones o coloides), por el tamaño. El agua de mar, el agua carbonatada, el aire, la gasolina, las monedas, los líquidos que fluyen en nuestro organismo acarreando gran variedad de nutrientes indispensables, sales y otros minerales, son ejemplos de soluciones. Veamos el siguiente mapa conceptual que nos permitirá comprender mejor este concepto:
En química las soluciones son útiles para una serie de procesos que contribuyen al avance de la medicina y de la industria. Sin embargo, siempre es necesario, además de conocer el soluto y solvente apropiado, saber cuáles son las cantidades que se necesitan para su fabricación, lo que se denomina concentración. Observemos el siguiente video que nos ayudará a comprender mejor el concepto de soluto y solvente.
Te propongo que antes de avanzar al documento y el taller, observes el siguiente video y en el numeral 2 respondas las preguntas que allí se encuentran.
Doc: Características de las soluciones
Taller N°1 - Características de las soluciones
B) Tipos de soluciones
Una forma de clasificar a las soluciones es según el estado físico del solvente, como soluciones sólidas, líquidas y gaseosas.
- Sólidas, como las aleaciones, por ejemplo el bronce, (mezcla de Cobre y Estaño).
- Líquidas, como el agua de mar, el té y el café, los jugos y la gasolina.
- Gaseosa, como el aire, que es una mezcla de gases.
Las soluciones se pueden clasificar de distintas maneras, entre ellas según la cantidad de soluto y solvente, o en otras palabras según su concentración. Miremos:
La solubilidad es entonces la capacidad que tiene una sustancia para disolverse en otra,; también puede entenderse como la máxima cantidad de soluto que puede disolverse en una cierta cantidad de solvente a una temperatura determinada. En el siguiente link podrás encontrar una corta simulación sobre este tema y podrás responder 3 sencillas preguntas al respecto. Anímate...
Para que dos sustancias puedan formar una
solución, se necesita que seas miscibles, es decir, que se puedan mezclar
íntimamente y que este proceso se dé a escala iónica o molecular. En las
soluciones se presentan fuerzas de atracciones intermoleculares, sean estas de
naturaleza iónica, covalente, de puentes de hidrógeno o fuerzas de van der
wall. Al mezclar compuestos diferentes, sus moléculas se ven obligadas a entrar
en contacto y para que se dispersen homogéneamente se requiere superar las
fuerzas de atracción tanto del soluto como del solvente; de esta manera las
moléculas del solvente pueden separarse para abrir paso a las del soluto y
luego rodearlas.
La solubilidad es entonces la capacidad que tiene una sustancia para disolverse en otra,; también puede entenderse como la máxima cantidad de soluto que puede disolverse en una cierta cantidad de solvente a una temperatura determinada.
La solubilidad de un soluto en un solvente depende de varios factores como: el tamaño de las partículas dispersas, la naturaleza del soluto y el solvente, la temperatura, la presión y . Veamos el siguiente esquema:
La solubilidad es entonces la capacidad que tiene una sustancia para disolverse en otra,; también puede entenderse como la máxima cantidad de soluto que puede disolverse en una cierta cantidad de solvente a una temperatura determinada.
La solubilidad de un soluto en un solvente depende de varios factores como: el tamaño de las partículas dispersas, la naturaleza del soluto y el solvente, la temperatura, la presión y . Veamos el siguiente esquema:
El tamaño de las partículas dispersas: cuando se mezcla un soluto en un solvente, podría entenderse en términos generales que entre más pequeñas sean las partículas del soluto más rápido se podrá disolver en el solvente; un ejemplo son los jugos en polvo cuyas granos o partículas son muy pequeñas para facilitar su disolución.
Naturaleza del soluto y solvente: conocemos que para que una sustancia se disuelva en otra es necesario que tengan la misma polaridad, es decir, sustancias polares se disuelven en solventes polares, como la sal en agua. Si el soluto y el solvente tienen diferentes polaridades no se podrán disolver, como el agua y el aceite.
Temperatura: en general, los solutos sólidos y líquidos aumentan su solubilidad al aumentar la temperatura, no ocurre lo mismo con los gases, los cuales se hacen menos solubles al aumentar la temperatura. Por ejemplo, cuando aumenta la temperatura de los océanos, la solubilidad del oxígenos disminuye, con el consiguiente daño para las especies que lo habitan.
Presión: en el caso de sólidos y líquidos, la presión no afecta la solubilidad o esta es despreciable. Sólo si se trata de un gas, al aumentar la presión a la que está sometido ocurre una mayor compenetración entre el soluto y el solvente, lo cual se manifiesta en una mayor solubilidad. Cuando se prepara una solución, las propiedades físicas del solvente cambian por la cantidad de partículas que se adicionan al añadir el soluto. Estas propiedades se denominan propiedades coligativas, que son: aumento en el punto de ebullición, disminución en el
Te propongo ahora revisar las siguientes preguntas que te llevarán a una mejor comprensión acerca de la solubilidad.
Si aun presentas alguna dura con respecto a esta parte del concepto, te invito a leer el siguiente documento y posteriormente a realizar el taller N°2:
Taller N°2 - Solubilidad
D) Las propiedades coligativas
Cuando se prepara una solución, las propiedades
físicas del solvente cambian por la cantidad de partículas que se adicionan al
añadir el soluto. Estas propiedades se han
denominado propiedades coligativas, que son: aumento en el punto de ebullición, disminución en el punto de
congelación, disminución de la presión de vapor y la presión osmótica. Estas
propiedades son importantes porque permiten determinar
la concentración de una solución y la masa molecular de un soluto,
preparar sueros para usos médicos, preparar anticongelantes que evitan que
el agua se solidifique en el radiador de un auto en los países que tienen
estaciones.
Veamos a continuación la definición de cada una de ellas:
Proceso de ósmosis
E) Concentración de las soluciones
La concentración de una solución es la relación que existe entre la cantidad de soluto y la cantidad de solvente presente, o la cantidad de solución. Se expresa en unidades físicas y en unidades químicas de concentración. Veamos:
Unidades físicas de concentración:
Indican el número de gramos de soluto en una cantidad fija de solución. En este grupo de unidades se encuentra el porcentaje (%), que se define como las partes de soluto que hay en 100 partes de solución.
La concentración puede expresarse en unidades de masa o de volumen.
Otra forma de medir la concentración son las unidades químicas. La diferencia con las unidades físicas es que para determinar las unidades químicas es necesario conocer los solutos que intervienen en la formación de la solución. Las unidades químicas son: molaridad, molalidad y normalidad. Veamos:
Vamos ahora a afianzar los cálculos relacionados con las unidades de concentración físicas y químicas a través de los siguientes ejercicios.
Actividad de afianzamiento
Profundicemos y aclaremos dudas observando el siguiente video que, además de presentarnos más explicaciones sobre la forma de hallar las concentraciones en las soluciones, nos hace un repaso de los conceptos más importantes en este tema.
Ahora realizaremos el taller N°3.
Taller de afianzamiento y nivelación.
TALLER PARA AFIANZAR Y PROFUNDIZAR
PER 2 - QUÍMICA ORGÁNICA
Nada toca tanto al ser humano, como los estudios que se han hecho en química orgánica. La síntesis de medicamentos, combustibles, fertilizantes, pesticidas, plásticos, textiles, tintas, lubricantes, explosivos, asfaltos, esencias aromáticas, cosméticos, solventes y diversos materiales más complejos se ha dado gracias al cuerpo de conocimientos que constituye la química orgánica.
El campo de acción actual de la química orgánica se centra en la síntesis de nuevos compuestos y materiales. Por ejemplo, se desarrollan materiales para elaborar bolsas que retarden la maduración de frutos o la descomposición de alimentos de manera que puedan conservarse por periodos de tiempo que tarda su transporte hasta los lugares donde se consume. Además, la síntesis de nuevos combustibles, fertilizantes y pesticidas amigables con el planeta, telas y muchos otros campos de acción, hacen de la química orgánica una disciplina de pleno auge y desarrollo.
Para el aprendizaje de esta importante disciplina, en este blog abordaremos algunos conceptos como los siguientes:
1.Historia e importancia de la química orgánica.
2.Elementos que constituyen los compuestos orgánicos y diferencias de estos compuestos con los inorgánicos.
3.La química del Carbono (Características, fuentes, enlace, configuración, geometría molecular, tetravalencia, hibridación, clasificación de los átomos de carbono).
4.Fórmulas químicas( empírica, molecular, esquemática o estructural, espacial o estereoquímica y electrónica).
5.Compuestos orgánicos (Clasificación, nomenclatura y reacciones orgánicas).
6.Hidrocarburos: saturados (alcanos), Insaturados (alquenos y alquinos), el petróleo, la gasolina, los polímeros, hidrocarburos cíclicos y aromáticos).
Para ilustrar mejor esta parte, te invito a darle clic al siguiente enlace (Historia de la química) para ver el video; luego, realiza la actividad que se propone (actividad 1 - nota 1).
Para afianzar conceptos y valorar lo aprendido hasta este momento, te propongo realizar el siguiente taller bajo las indicaciones dadas en clase:
2. Elementos que constituyen los compuestos orgánicos y diferencias de estos compuestos con los inorgánicos.
Los compuestos orgánicos están formados principalmente por átomos de carbono e hidrógeno, también pueden haber átomos de oxígeno, nitrógeno y azufre, y en menor proporción otros elementos. Para que profundices más en este aspecto, te propongo observar el siguiente video.
Ahora, diviértete un rato encontrando los conceptos más importantes vistos hasta ahora en la siguiente sopa de letras.
3.La química del Carbono (Características, fuentes, enlace, configuración, geometría molecular, tetravalencia, hibridación, clasificación de los átomos de carbono).
Es tanta la importancia de la química del carbono que constituye una de las ramas de la química de más vasto campo de estudio: la Química Orgánica.
La Química Orgánica se define como la rama de la Química que estudia la estructura, comportamiento, propiedades y usos de los compuestos que contienen carbono. Esta definición excluye algunos compuestos tales como los óxidos de carbono, las sales del carbono y los cianuros y derivados, los cuales por sus características pertenecen al campo de la química inorgánica. Pero éstos, son solo unos cuantos compuestos contra los miles de compuestos que estudia la química orgánica.
A este campo de estudio se le conoce como “química orgánica” porque durante un tiempo se creyó que éstos compuestos provenían forzosamente de organismos vivos, teoría conocida como de la “fuerza vital”. Fue hasta 1828 que el químico alemán Federico Wöhler (1800-1882) obtuvo urea H2N-CO-NH2 calentando HCNO (ácido ciánico) y NH3 (amoniaco) cuando intentaba preparar NH4CNO (cianato de amonio), con la cual se echó por tierra la teoría de la fuerza vital.
La Química Orgánica estudia aspectos tales como:
Estos son solo algunos de los muchos ejemplos que podríamos citar sobre el estudio de la química orgánica.
A pesar de que la química es una sola, está perfectamente justificada la consideración de los compuestos del carbono en una disciplina separada. El carbono presenta particularidades que lo distinguen de todos los otros elementos de la Tabla Periódica.
Se destaca la extraordinaria capacidad del carbono para formar compuestos diferentes. Esto se traduce en el hecho de que más del 95% de todas las sustancias conocidas contiene carbono. Además del agua y pequeñas cantidades de minerales, los compuestos fundamentales de todos los sistemas biológicos son sustancias orgánicas.
Para que profundices más en este aspecto, te propongo leer el siguiente documento, en él encontrarás ejemplos, cuadros comparativos y explicaciones a procesos generados a partir del átomo de carbono.
El siguiente video te ayudará a aclarar posibles dudas que tengas aún después de haber leído el anterior documento.
Con el fin de comprender mucho mejor lo relacionado de manera específica con la hibridación del carbono y la isomería cis - trans, acércate con una excelente lectura al siguiente documento, para ello dale clic al siguiente link:
Ahora, para afianzar y/o reforzar lo visto, desarrolla el siguiente taller y prepárate para sustentación en clase (oral o quiz escrito).
4.Fórmulas químicas( empírica, molecular, esquemática o estructural, espacial o estereoquímica y electrónica).
LOS HIDROCARBUROS
Para el inicio de este concepto, te propongo darle clic al link que dice: ¿qué son los hidrocarburos y cómo se clasifican?, ahí podrás encontrar en la primera página un introducción sobre ellos, introducción que te permitirá ampliar tu nivel de comprensión. Solamente centrarás tu atención en las primeras dos páginas que describen a los hidrocarburos. Para esa página te propongo extraer las 5 ideas que te parezcan más importantes y tomar nota del mapa conceptual al que allí se proponen.
¿Qué son los hidrocarburos y cómo se clasifican?
Actividad N°1
Luego de haber leído la descripción de los hidrocarburos y haber comprendido sobre algunas de sus características más relevantes, vamos a observar el siguiente video para afianzar tus conocimientos al respecto. En la parte superior del video se observan los números (1 y 2), el video está ubicado en el numeral 1. Observa el video
Ahora dale clic al numeral 2 y encontrarás algunas ideas concluyentes muy importantes sobre lo visto en el video. Puedes seguir pasando de pestaña oprimiendo la direccional, al llegar a la última pestaña encontrarás 3 ideas destacables sobre el carbono, toma nota de ellas ya que serán discutidas en clase. No olvides responder la pregunta propuesta en el numeral 2.
Luego de realizar la actividad N°1 sobre hidrocarburos (video y pestañas con ideas relevantes), vamos al desarrollo de la actividad N°2.
Actividad N°2
LOS HIDROCARBUROS - ALCANOS
Ingresa al siguiente link (libro interactivo - Los Hidrocarburos ¿Qué son?) lee la introducción (repaso sobre hidrocarburos) y concentra toda tu atención en el capítulo 1(Hidrocarburos saturados o alcanos). Toma nota completa de lo presentado en ese capítulo.
Los Hidrocarburos ¿Qué son?
Ahora puedes aclarar dudas o fortalece lo prendido sobre este capítulo viendo el siguiente video:
Realiza la actividad propuesta a continuación y preséntala al docente.
LOS HIDROCARBUROS - ALQUENOS
Para continuar con los hidrocarburos, ahora identificaremos a los alquenos o hidrocarburos insaturados; para esto nos volveremos a enfocar en el documento que se encuentra en el link: Los hidrocarburos ¿Qué son? En esta parte el estudiante deberá tomar nota solamente de las ideas presentadas sobre los alquenos y sus características.
Luego, volveremos sobre el link que nos lleva al documento titulado ¿Qué son los hidrocarburos y cómo se clasifican? Esta vez iniciaremos en la página 11 y hasta la página 14. De la primera parte te sugiero retomar 3 ideas claves sobre los alquenos. Lee con mucha atención las reglas de nomenclatura de los alquenos presentadas en la página 12 y parte de la 13. Realiza los siguientes ejercicios para que practiques:
LOS HIDROCARBUROS - ALQUINOS
Para finalizar esta primera parte de los hidrocarburos y luego de haber comprendido los aspectos más importantes de los alcanos (hidrocarburos saturados) y de los alquenos (hidrocarburos insaturdos), pasaremos al último grupo de los hidrocarburos alifáticos y al segundo de los insaturados, los alquinos. Para su comprensión volveremos sobre el documento denominado: Los hidrocarburos ¿Qué son? En este punto tomaremos nota completa de las ideas ahí mencionadas, ideas ubicadas en las últimas 2 páginas del documento virtual. Luego, volveremos al documento en pdf denominado: ¿Qué son los hidrocarburos y cómo se clasifican? , el cual ha sido abordado en los dos conceptos anteriores.
En este punto centraremos nuestra atención a partir de la página 15 y hasta la 17, de manera especial en lo relacionado con la nomenclatura. Te propongo solucionar el siguiente taller:
A modo de resumen puedes acercarte a la siguiente tabla en donde encontrarás las características más relevantes de los alcanos, alquenos y alquinos:
La tarea o actividad de profundización será la siguiente:
En este momento daremos paso a la solución del taller propuesto para fortalecer lo visto hasta ahora en relación a los hidrocarburos saturados e insaturados.
Taller N° 3 - Alcanos, alquenos y alquinos.
LOS HIDROCARBUROS ALICÍCLICOS (CÍCLICOS) Y AROMÁTICOS
Los Hidrocarburos cíclicos (cicloalcanos, cicloalquenos y cicloalquinos)
En este apartado centraremos nuestra atención en los hidrocarburos de cadena cerrada. Éstos, que también son denominados alicíclicos, se clasifican en cicloalcanos, cicloalquenos y cicloalquinos. Algunas propiedades de estos compuestos son:
A continuación te invito a darle clic al siguiente link para conocer las propiedades físicas de los compuestos cíclicos:
Para afianzar más este concepto, te sugiero darle clic al siguiente link; éste te llevará a un documento en pdf en el cual fijarás tu atención en las páginas de la 1 a la 5 para tratar inicialmente las características de los cicloalcanos, cicloalquenos y cicloalquinos.
Los hidrocarburos aromáticos son derivados del benceno, líquido de punto de ebullición 80ºC, inmiscible en agua, buen disolvente de compuestos orgánicos, como colorantes, barnices, etc., y materia prima base de muchas sustancias de la industria química. El benceno es le compuesto más sencillo de un grupo de moléculas orgánicas conocidas como aromáticas. Es muy conocido y de extenso uso industrial. El término aromático hizo alusión al aroma característico de algunos de los primeros compuestos de esta clase que se descubrieron y estudiaron. Sin embargo, hoy, el olor no tiene significación para definir la naturaleza química de estas sustancias, sino que es la especial estructura molecular de estos compuestos la que da características peculiares. Es más, hoy se conocen compuestos aromáticos que no tiene olor que los identifiquen. El Benceno Es un hidrocarburo, que luego de repetidos análisis y determinaciones de su peso molecular, se demostró que tiene la formula C6H6.
Para que sigas afianzando este concepto, dale nuevamente clic al link anterior (Los Hidrocarburos cíclicos y aromáticos). Lee sobre el benceno, sus características. En este punto toma nota de todo lo mencionado en el apartado de nomenclatura, las propiedades físicas y químicas de los hidrocarburos aromáticos y finalmente sus usos.
Para finalizar, lee sobre los derivados halogenados, construye la tabla de ejemplos para su discusión en clase.
GRUPOS FUNCIONALES DEL CARBONO
Las propiedades de los compuestos de carbono dependen del arreglo de sus cadenas y tipos de átomos a los que están unidos, esto es, a su estructura.
Un grupo funcional es un átomo o un arreglo de átomos que siempre reaccionan de una forma determinada; además, es la parte de la molécula responsable de su comportamiento químico ya que le confiere propiedades características. Muchos compuestos orgánicos contienen más de un grupo funcional.
Existen distintos grupos funcionales, los cuales se pueden clasificar de la siguiente forma:
Para profundizar mucho más en este concepto, te sugiero visitar la siguiente página. Solamente con un clic podrás encontrar definiciones, cuadro, actividades interactivas, elaboración de modelos, entre otras. Anímate, lee y aprende.
A) Alcoholes, fenoles y éteres.
En el siguiente link encontraremos un video que nos introducirá en la química de estos 3 compuestos orgánicos.
El campo de acción actual de la química orgánica se centra en la síntesis de nuevos compuestos y materiales. Por ejemplo, se desarrollan materiales para elaborar bolsas que retarden la maduración de frutos o la descomposición de alimentos de manera que puedan conservarse por periodos de tiempo que tarda su transporte hasta los lugares donde se consume. Además, la síntesis de nuevos combustibles, fertilizantes y pesticidas amigables con el planeta, telas y muchos otros campos de acción, hacen de la química orgánica una disciplina de pleno auge y desarrollo.
Para el aprendizaje de esta importante disciplina, en este blog abordaremos algunos conceptos como los siguientes:
1.Historia e importancia de la química orgánica.
2.Elementos que constituyen los compuestos orgánicos y diferencias de estos compuestos con los inorgánicos.
3.La química del Carbono (Características, fuentes, enlace, configuración, geometría molecular, tetravalencia, hibridación, clasificación de los átomos de carbono).
4.Fórmulas químicas( empírica, molecular, esquemática o estructural, espacial o estereoquímica y electrónica).
5.Compuestos orgánicos (Clasificación, nomenclatura y reacciones orgánicas).
6.Hidrocarburos: saturados (alcanos), Insaturados (alquenos y alquinos), el petróleo, la gasolina, los polímeros, hidrocarburos cíclicos y aromáticos).
1. Historia e importancia de la química orgánica.
Para ilustrar mejor esta parte, te invito a darle clic al siguiente enlace (Historia de la química) para ver el video; luego, realiza la actividad que se propone (actividad 1 - nota 1).
2. Elementos que constituyen los compuestos orgánicos y diferencias de estos compuestos con los inorgánicos.
Es tanta la importancia de la química del carbono que constituye una de las ramas de la química de más vasto campo de estudio: la Química Orgánica.
La Química Orgánica se define como la rama de la Química que estudia la estructura, comportamiento, propiedades y usos de los compuestos que contienen carbono. Esta definición excluye algunos compuestos tales como los óxidos de carbono, las sales del carbono y los cianuros y derivados, los cuales por sus características pertenecen al campo de la química inorgánica. Pero éstos, son solo unos cuantos compuestos contra los miles de compuestos que estudia la química orgánica.
A este campo de estudio se le conoce como “química orgánica” porque durante un tiempo se creyó que éstos compuestos provenían forzosamente de organismos vivos, teoría conocida como de la “fuerza vital”. Fue hasta 1828 que el químico alemán Federico Wöhler (1800-1882) obtuvo urea H2N-CO-NH2 calentando HCNO (ácido ciánico) y NH3 (amoniaco) cuando intentaba preparar NH4CNO (cianato de amonio), con la cual se echó por tierra la teoría de la fuerza vital.
La Química Orgánica estudia aspectos tales como:
- Los componentes de los alimentos: carbohidratos, lípidos, proteínas y vitaminas.
- Industria textil.
- Madera y sus derivados.
- Industria farmacéutica
- Industria alimenticia.
- Petroquímica.
- Jabones y detergentes.
- Cosmetología.
Estos son solo algunos de los muchos ejemplos que podríamos citar sobre el estudio de la química orgánica.
A pesar de que la química es una sola, está perfectamente justificada la consideración de los compuestos del carbono en una disciplina separada. El carbono presenta particularidades que lo distinguen de todos los otros elementos de la Tabla Periódica.
Se destaca la extraordinaria capacidad del carbono para formar compuestos diferentes. Esto se traduce en el hecho de que más del 95% de todas las sustancias conocidas contiene carbono. Además del agua y pequeñas cantidades de minerales, los compuestos fundamentales de todos los sistemas biológicos son sustancias orgánicas.
Para que profundices más en este aspecto, te propongo leer el siguiente documento, en él encontrarás ejemplos, cuadros comparativos y explicaciones a procesos generados a partir del átomo de carbono.
El siguiente video te ayudará a aclarar posibles dudas que tengas aún después de haber leído el anterior documento.
Ahora, para afianzar y/o reforzar lo visto, desarrolla el siguiente taller y prepárate para sustentación en clase (oral o quiz escrito).
4.Fórmulas químicas( empírica, molecular, esquemática o estructural, espacial o estereoquímica y electrónica).
La fórmula química es una representación gráfica de la
molécula que muestra las especies atómicas que la conforman.
Uno de los resultados finales de los métodos de análisis y síntesis es la elucidación de la fórmula del compuesto. Para una misma sustancia existen distintos tipos de fórmulas, cada una de las cuales proporciona información diferente.
Veamos a continuación las definiciones y ejemplos para cada fórmula química:
Veamos otros ejemplos:
Uno de los resultados finales de los métodos de análisis y síntesis es la elucidación de la fórmula del compuesto. Para una misma sustancia existen distintos tipos de fórmulas, cada una de las cuales proporciona información diferente.
Veamos a continuación las definiciones y ejemplos para cada fórmula química:
Veamos otros ejemplos:
El siguiente video te ayudará a aclarar posibles dudas que tengas aún después de haber estado en clase y completar el cuadro anterior.
5.Compuestos orgánicos (Clasificación, nomenclatura y reacciones orgánicas).
Antes de dar inicio a esta actividad, te propongo participar en un juego muy sencillo donde pondrás a prueba tus saberes previos sobre los hidrocarburos. Si te equivocas no importa, corrige y continúa... ANÍMATE!!!
Para ampliar nuestro conocimiento sobre los
Hidrocarburos alifáticos (alcanos, alquenos y alquinos) a continuación
tendremos una serie de videos, documentos, talleres y páginas de actividades
que nos ayudarán a comprender mucho mejor este concepto.
LOS HIDROCARBUROS
Para el inicio de este concepto, te propongo darle clic al link que dice: ¿qué son los hidrocarburos y cómo se clasifican?, ahí podrás encontrar en la primera página un introducción sobre ellos, introducción que te permitirá ampliar tu nivel de comprensión. Solamente centrarás tu atención en las primeras dos páginas que describen a los hidrocarburos. Para esa página te propongo extraer las 5 ideas que te parezcan más importantes y tomar nota del mapa conceptual al que allí se proponen.
¿Qué son los hidrocarburos y cómo se clasifican?
Actividad N°1
Luego de haber leído la descripción de los hidrocarburos y haber comprendido sobre algunas de sus características más relevantes, vamos a observar el siguiente video para afianzar tus conocimientos al respecto. En la parte superior del video se observan los números (1 y 2), el video está ubicado en el numeral 1. Observa el video
Luego de realizar la actividad N°1 sobre hidrocarburos (video y pestañas con ideas relevantes), vamos al desarrollo de la actividad N°2.
Actividad N°2
LOS HIDROCARBUROS - ALCANOS
Ingresa al siguiente link (libro interactivo - Los Hidrocarburos ¿Qué son?) lee la introducción (repaso sobre hidrocarburos) y concentra toda tu atención en el capítulo 1(Hidrocarburos saturados o alcanos). Toma nota completa de lo presentado en ese capítulo.
Los Hidrocarburos ¿Qué son?
Ahora puedes aclarar dudas o fortalece lo prendido sobre este capítulo viendo el siguiente video:
Para comprender mejor lo relacionado con la nomenclatura de los alcanos, volveremos sobre el documento denominado ¿Qué son los hidrocarburos y cómo se clasifican? (documento tenido en cuenta antes de la actividad N° 1, algunas ideas arriba). En este documento centraremos nuestra atención desde la páginas 2 hasta la 8, páginas en las que se explica el proceso a tener en cuenta par nombrar compuestos saturados.
La siguiente tabla recopila las bases para comprender la nomenclatura de alcanos.
Igualmente es necesario comprender e identificar los nombres de los radicales; es decir, aquellos grupos o cadenas de carbono que se encuentran externas a mi cadena principal. Veamos a continuación estos grupos:
Para continuar con los hidrocarburos, ahora identificaremos a los alquenos o hidrocarburos insaturados; para esto nos volveremos a enfocar en el documento que se encuentra en el link: Los hidrocarburos ¿Qué son? En esta parte el estudiante deberá tomar nota solamente de las ideas presentadas sobre los alquenos y sus características.
Luego, volveremos sobre el link que nos lleva al documento titulado ¿Qué son los hidrocarburos y cómo se clasifican? Esta vez iniciaremos en la página 11 y hasta la página 14. De la primera parte te sugiero retomar 3 ideas claves sobre los alquenos. Lee con mucha atención las reglas de nomenclatura de los alquenos presentadas en la página 12 y parte de la 13. Realiza los siguientes ejercicios para que practiques:
LOS HIDROCARBUROS - ALQUINOS
Para finalizar esta primera parte de los hidrocarburos y luego de haber comprendido los aspectos más importantes de los alcanos (hidrocarburos saturados) y de los alquenos (hidrocarburos insaturdos), pasaremos al último grupo de los hidrocarburos alifáticos y al segundo de los insaturados, los alquinos. Para su comprensión volveremos sobre el documento denominado: Los hidrocarburos ¿Qué son? En este punto tomaremos nota completa de las ideas ahí mencionadas, ideas ubicadas en las últimas 2 páginas del documento virtual. Luego, volveremos al documento en pdf denominado: ¿Qué son los hidrocarburos y cómo se clasifican? , el cual ha sido abordado en los dos conceptos anteriores.
En este punto centraremos nuestra atención a partir de la página 15 y hasta la 17, de manera especial en lo relacionado con la nomenclatura. Te propongo solucionar el siguiente taller:
A modo de resumen puedes acercarte a la siguiente tabla en donde encontrarás las características más relevantes de los alcanos, alquenos y alquinos:
La tarea o actividad de profundización será la siguiente:
En este momento daremos paso a la solución del taller propuesto para fortalecer lo visto hasta ahora en relación a los hidrocarburos saturados e insaturados.
Taller N° 3 - Alcanos, alquenos y alquinos.
Los Hidrocarburos cíclicos (cicloalcanos, cicloalquenos y cicloalquinos)
En este apartado centraremos nuestra atención en los hidrocarburos de cadena cerrada. Éstos, que también son denominados alicíclicos, se clasifican en cicloalcanos, cicloalquenos y cicloalquinos. Algunas propiedades de estos compuestos son:
A continuación te invito a darle clic al siguiente link para conocer las propiedades físicas de los compuestos cíclicos:
Para afianzar más este concepto, te sugiero darle clic al siguiente link; éste te llevará a un documento en pdf en el cual fijarás tu atención en las páginas de la 1 a la 5 para tratar inicialmente las características de los cicloalcanos, cicloalquenos y cicloalquinos.
Los Hidrocarburos aromáticos (Benceno)
Los hidrocarburos aromáticos son derivados del benceno, líquido de punto de ebullición 80ºC, inmiscible en agua, buen disolvente de compuestos orgánicos, como colorantes, barnices, etc., y materia prima base de muchas sustancias de la industria química. El benceno es le compuesto más sencillo de un grupo de moléculas orgánicas conocidas como aromáticas. Es muy conocido y de extenso uso industrial. El término aromático hizo alusión al aroma característico de algunos de los primeros compuestos de esta clase que se descubrieron y estudiaron. Sin embargo, hoy, el olor no tiene significación para definir la naturaleza química de estas sustancias, sino que es la especial estructura molecular de estos compuestos la que da características peculiares. Es más, hoy se conocen compuestos aromáticos que no tiene olor que los identifiquen. El Benceno Es un hidrocarburo, que luego de repetidos análisis y determinaciones de su peso molecular, se demostró que tiene la formula C6H6.
Para que sigas afianzando este concepto, dale nuevamente clic al link anterior (Los Hidrocarburos cíclicos y aromáticos). Lee sobre el benceno, sus características. En este punto toma nota de todo lo mencionado en el apartado de nomenclatura, las propiedades físicas y químicas de los hidrocarburos aromáticos y finalmente sus usos.
Para finalizar, lee sobre los derivados halogenados, construye la tabla de ejemplos para su discusión en clase.
Ahora, para afianzar todo lo visto sobre hidrocarburos cíclicos y aromáticos, desarrollarás el siguiente taller.
GRUPOS FUNCIONALES DEL CARBONO
Las propiedades de los compuestos de carbono dependen del arreglo de sus cadenas y tipos de átomos a los que están unidos, esto es, a su estructura.
Un grupo funcional es un átomo o un arreglo de átomos que siempre reaccionan de una forma determinada; además, es la parte de la molécula responsable de su comportamiento químico ya que le confiere propiedades características. Muchos compuestos orgánicos contienen más de un grupo funcional.
Existen distintos grupos funcionales, los cuales se pueden clasificar de la siguiente forma:
Para profundizar mucho más en este concepto, te sugiero visitar la siguiente página. Solamente con un clic podrás encontrar definiciones, cuadro, actividades interactivas, elaboración de modelos, entre otras. Anímate, lee y aprende.
A) Alcoholes, fenoles y éteres.
En el siguiente link encontraremos un video que nos introducirá en la química de estos 3 compuestos orgánicos.
Qué responderías a las siguientes preguntas:
En la siguiente tabla puedes identificar algunas propiedades físicas de estos compuestos:
Ahora ha llegado el momento de comprender con más claridad estos tres grupos funcionales; para ello, dale clic al siguiente documento, es un texto en pdf que explica las características, propiedades, reglas de nomenclatura y reactividad de cada uno.
Para finalizar, ingresa al siguiente link; en
éste hallarás cuadros comparativos, tablas y actividades
relacionadas con este grupo de compuestos orgánicos. Luego
hallarás un link que te llevará al taller de esta unidad.
Documento final (Alcoholes, Fenoles y Éteres)
Taller N° 5 - Compuestos oxigenados (Alcoholes, Fenoles y Éteres)
B) Aldehídos y cetonas.
Con el objetivo de comprender a profundidad las características de estos
dos compuestos, te sugiero observar el siguiente video y luego responder las
preguntas que se presentan en la imagen después del video.
Qué responderías a las siguientes preguntas:
Con ayuda del siguiente documento podrás aumentar tu nivel de comprensión sobre los aldehídos y las cetonas. Inicia observando la siguiente imagen:
A modo de resumen sobre las propiedades físicas de los aldehídos y cetonas es posible presentar el siguiente resumen:
Actividad N°1
Taller N° 6 - Compuestos Oxigenados (Aldehídos y Cetonas)
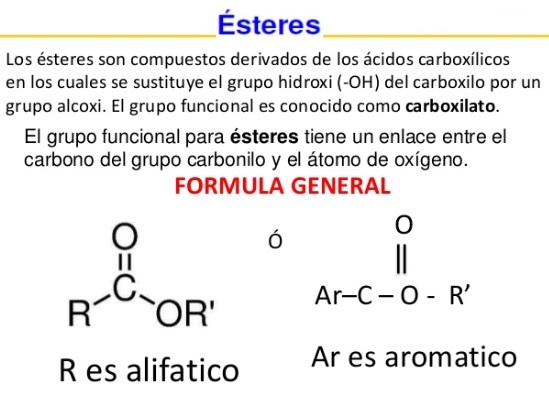
C) Ácidos Carboxílicos y Ésteres
Iniciaremos este concepto observando el siguiente video y respondiendo las preguntas que se presentan después del mismo.
Video: Usos e importancia de algunas sustancias orgánicas en la vida cotidiana.
Ahora lee y piensa en las respuestas a las siguientes preguntas:
El grupo carboxilo, es uno de los grupos funcionales más abundantes en la química y bioquímica. No solo los ácidos carboxílicos son importantes en sí mismos, sino el grupo carboxilo es el grupo del cual se deriva una gran familia de compuestos.
Video: Usos e importancia de algunas sustancias orgánicas en la vida cotidiana.
El grupo carboxilo, es uno de los grupos funcionales más abundantes en la química y bioquímica. No solo los ácidos carboxílicos son importantes en sí mismos, sino el grupo carboxilo es el grupo del cual se deriva una gran familia de compuestos.
Es una función de carbono primario. Se caracteriza por tener en el mismo
carbono el grupo carbonilo y un hidroxilo. Se nombra anteponiendo la palabra
ácido y el sufijo oico. Algunos de ellos son más conocidos por sus nombres comunes
como el ácido fórmico (metanoico) y el ácido acético (etanoico).
Los ácidos crboxilicos son compuestos
caracterizados por la presencia del grupo carboxilo (-COOH, -CO2H o -CHOO) unido a un
grupo arilo o alquilo. Cuando la cadena carbonada presenta un sólo grupo
carboxilo, los ácidos se llaman monocarboxílicos o ácidos grasos, se denomina
así ya que se obtienen por hidrólisis de las grasas.
Miremos sus puntos de ebullición y solubilidad en la siguiente tabla.
A continuación se presentan algunos esquemas que nos permitirán identificar su estructura en cadena:
Miremos sus puntos de ebullición y solubilidad en la siguiente tabla.
A continuación se presentan algunos esquemas que nos permitirán identificar su estructura en cadena:
Para ver sus usos y aplicaciones en la vida cotidiana, reforzaremos los conceptos a través de la siguiente actividad que incluye preguntas, video y actividad práctica (dar clic al link):
Actividad N°2
Algunos ejemplos de estos ácidos carboxilicos los veremos en el siguiente link:
De manera inmediata encontrarás un ejemplo
para nombrar estos compuestos.
A continuación conoceremos sobre los éteres, otro compuesto orgánico de mucha utilidad en la vida cotidiana.
Para profundizar más en este concepto, te sugiero ingresar al siguiente documento en el cual encontrarás información relacionada con los ésteres y los ácidos carboxílicos, compuestos orgánicos de donde los primeros derivan.
Compuestos oxigenados: ácidos carboxílicos y ésteres.
Veamos ahora algunas imágenes que nos permitirán resumir las características de estos compuestos:
D) Aminas, Amidas y Nitrilos
Compuestos oxigenados: ácidos carboxílicos y ésteres.
Veamos ahora algunas imágenes que nos permitirán resumir las características de estos compuestos:
Ahora aprenderemos sobre las aminas, las amidas y los nitrilos; pero antes de pasar a los contenidos leamos la siguiente historieta y respondamos las preguntas del cuadro al final.
Para esto te invito a que visites en el siguiente link un blog que te mostrará sus características más relevantes.
Para esto te invito a que visites en el siguiente link un blog que te mostrará sus características más relevantes.
Aminas, amidas y nitrilos.
Actividad de mejora
Finalmente hemos logrado abarcar los grupos funcionales orgánicos comprendiendo en ellos sus propiedades físicas y químicas, reglas para nomenclar, estructuras químicas, etc. Para concluir encontrarás un cuadro que resume las estructuras químicas de los grupos orgánicos con nombres y ejemplos. Luego encontrarás un link, éste te llevará a una página que contiene información de mucha importancia relacionada con los grupos carbonados, así como actividades para realizar en línea.
Finalmente hemos logrado abarcar los grupos funcionales orgánicos comprendiendo en ellos sus propiedades físicas y químicas, reglas para nomenclar, estructuras químicas, etc. Para concluir encontrarás un cuadro que resume las estructuras químicas de los grupos orgánicos con nombres y ejemplos. Luego encontrarás un link, éste te llevará a una página que contiene información de mucha importancia relacionada con los grupos carbonados, así como actividades para realizar en línea.
RESUMEN COMPUESTOS ORGÁNICOS - GRUPOS FUNCIONALES


























































































No hay comentarios:
Publicar un comentario